O desenvolvimento de uma vacina segue altos padrões de exigência e qualidade em todas as suas fases, o que inclui a pesquisa inicial, os testes em animais e humanos sob rigoroso protocolo de procedimentos éticos, até o processo de avaliação de resultados pelas agências reguladoras governamentais.
No Brasil, o órgão responsável pela avaliação dos resultados de segurança e eficácia de uma vacina e seu registro é a Agência Nacional de Vigilância Sanitária (Anvisa).
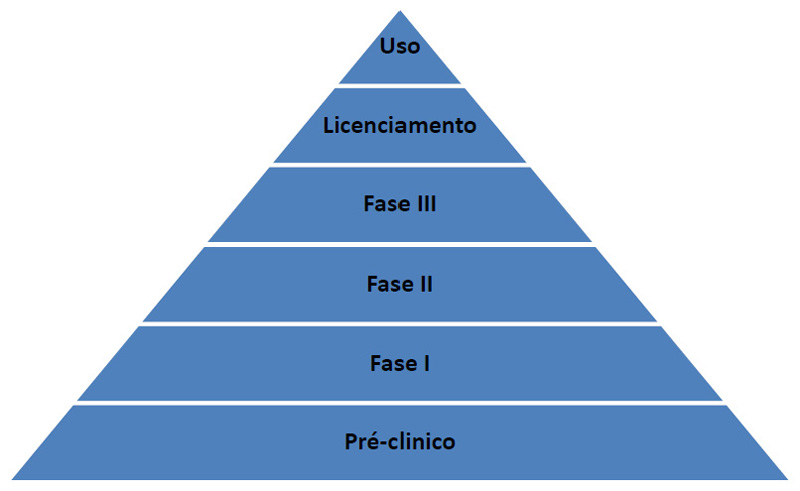
A Anvisa, por meio da Resolução (RDC) n. 55, de 16 de dezembro de 2010, estabelece os requisitos mínimos para o registro de produtos biológicos, entre eles as vacinas. As fases de desenvolvimento exigidas por essa RDC são semelhantes às exigidas pelo Centro de Prevenção e Controle de Doenças dos Estados Unidos (CDC). São elas:
- Fase exploratória ou laboratorial: Fase inicial ainda restrita aos laboratórios. Momento em que são avaliadas dezenas e até centenas de moléculas para se definir a melhor composição da vacina.
- Fase pré-clínica ou não clínica: Após a definição dos melhores componentes para a vacina, são realizados testes em animais para comprovação dos dados obtidos em experimentações in vitro.
- Fase clínica: Segundo a Agência de Medicina Europeia (EMA), um estudo ou ensaio clínico é “Qualquer investigação em seres humanos, objetivando descobrir ou verificar os efeitos farmacodinâmicos, farmacológicos, clínicos e/ou outros efeitos de produto(s) e/ou identificar reações adversas ao(s) produto(s) em investigação, com o objetivo de averiguar sua segurança e/ou eficácia”. Esta etapa é dividida em outras três:
- Fase 1: É a primeira avaliação do produto e tem como objetivo principal analisar a segurança e ajustes de dosagem e concentração. O grupo de voluntários costuma ser pequeno, de 20 a 80 pessoas — em geral, adultos saudáveis.
- Fase 2: Nesse momento, o objetivo é avaliar a resposta imune e obter informações mais detalhadas sobre a segurança. O número de pacientes que participa é de algumas centenas.
- Fase 3: Aqui, o objetivo é avaliar a eficácia e a segurança no público-alvo, aquele ao qual se destina a vacina, ou seja, se ela realmente protege da doença. O número de voluntários aumenta, chegando a milhares
- Fase 4: Após a aprovação pela Anvisa, o laboratório obtém o registro que o autoriza a produzir e distribuir a vacina em todo o território nacional. Como os estudos clínicos são realizados com um número de pessoas inferior ao que receberá a vacina, o laboratório continua acompanhando os resultados, a exemplo do que ocorre com outros medicamentos. O objetivo é monitorar a ocorrência dos eventos adversos.
Essas fases são conduzidas pelo laboratório fabricante e os resultados, quando demonstradas a eficácia e segurança da vacina, passam a integrar um dossiê que é encaminhado para a apreciação da Anvisa.
Esse acompanhamento também é realizado pelo Ministério da Saúde, por meio do Sistema de Vigilância de Eventos Adversos Pós-vacinação (EAPV) do Programa Nacional de Imunizações (PNI). O objetivo é quantificar e qualificar os eventos adversos para não haver dúvidas de que os riscos de complicações graves causadas pelas vacinas são nulos ou muito menores que os oferecidos pelas doenças contra as quais elas oferecem proteção.
Como existem sistemas de vigilância em diversos países, surgiu a necessidade de se estabelecer protocolos e definições uniformizadas, que permitam a comparação dos eventos adversos e outras informações a eles relacionadas. Para suprir esta necessidade, especialistas em segurança de vacinas organizaram o grupo Brighton Collaboration, que conta com a participação de milhares de pessoas, em mais de uma centena de países, e estabelece constantemente o processo de uniformização de casos de EAPV.
Todo esse cuidado é para garantir que o melhor produto seja disponibilizado à população, possibilitando, assim, a prevenção, o controle e até mesmo a erradicação de doenças, caso das vacinas contra varíola e poliomielite.